V pevných látkách způsobují elektrický proud volné elektrony, které se v nich usměrněně pohybují.
Kapaliny neobsahují volné elektrony, elektrický proud v nich vyvolává usměrněný pohyb kladných a záporných iontů.

Kapalné prostředí, v kterém se nachází volně pohyblivé ionty, nazýváme elektrolyt.
Většina čistých kapalin má velmi malou elektrickou vodivost Roztoky solí, kyselin a zásad ale vedou elektrický proud velmi dobře. Například chemicky čistá voda obsahuje většinou jen neutrální molekuly a nevede vůbec elektrický proud. Stává se vodivou, když v ní rozpustíme malé množství soli, kyseliny nebo zásady.
Rozpustíme-li kuchyňskou sůl (NaCl) ve vodě, nastane oddělení sodíku a chloru z krystalické mřížky a jejich difúze mezi molekuly vody.
Rozpad neutrálních molekul iontové sloučeniny na kladné a záporné ionty, které jsou v roztoku volně pohyblivé, nazýváme disociace.

Kuchyňská sůl tedy disociovala na ionty $ Na^+ $ a $ Cl^- $.
Spojí-li se rozštěpené ionty opačného znaménka opět v neutrální molekulu, říkáme, že nastala jejich rekombinace.
Až bude v elektrolytu stejný počet nově vznikajících iontových párů jako zanikajících, nastává dynamická rovnováha.
Vodivé desky, na které je v elektrolytu připojený zdroj napětí, jsou elektrody. Anoda je připojena na kladný pól zdroje a katoda na záporný pól.
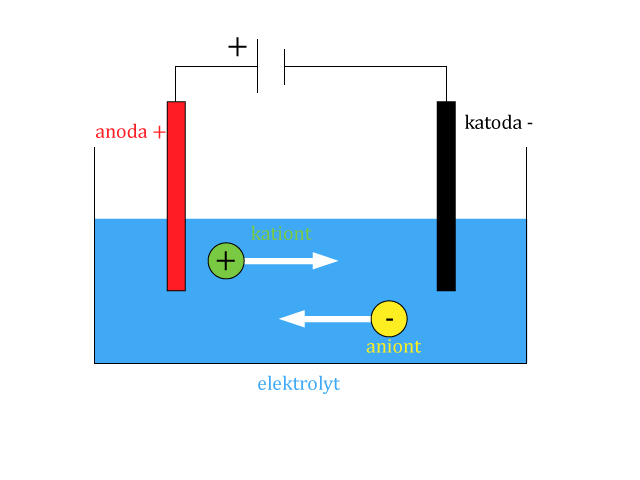
Je-li na elektrody připojený zdroj napětí, vznikne v elektrolytu elektrické pole. Tímto polem se ionty v elektrolytu uvedou do usměrněného pohybu a elektrolytem začne protékat elektrický proud.
Kladné ionty (kationty) se pohybují k záporné elektrodě (katodě) a záporné ionty (anionty) ke kladné elektrodě (anodě).
Ionty se zachytí na elektrodách. Při průchodu elektrického proudu elektrolytem dochází k přenosu látky.
Elektrický proud v kapalinách je způsoben uspořádaným usměrněným pohybem kladných a záporných iontů.
Děj, při kterém průchodem elektrického proudu elektrolytem nastává i přenos látky, se nazývá elektrolýza.
Mezi elektrodou a elektrolytem vzniká elektrolytické napětí.
Elektrody z různých látek mají ve stejném elektrolytu různé elektrolytické napětí. Na elektrodách odevzdají ionty svůj elektrický náboj elektrodám a usadí se na jejich povrchu. Množství látky, které se vyloučí na elektrodách, vyjadřuje 1. Faradayův zákon elektrolýzy:
$$ m = AQ = AIt $$
Hmotnost látky, která se vyloučí na elektrodě, je přímo úměrná prošlému elektrickému náboji.
Konstanta A je elektrochemický ekvivalent. Je rovna hmotnosti látky, která se vyloučí při stálém proudu 1A za 1s. Např. na vyloučení 1g vodíku je zapotřebí elektrický náboj 96500C.
Podle 2. Faradayova zákona je k vyloučení 1 kilogramekvivalentu jakékoliv látky potřebný stejně velký náboj. Tento náboj se označuje F a nazývá se Faradayova konstanta.
$$ F = 9,652 \cdot 10^7 C/kilogramekvivalent. $$
$$ A = \frac{M m}{F \cdot z} $$
Mm → molární hmotnost vyloučené látky
F → Faradayova konstanta
z → počet elementárních nábojů potřebných pro vyloučení jedné molekuly
1. Elektrolytické čištění kovů
2. Galvanické pokovování
3. Galvanoplastika
4. Galvanické leptání
5. Polarografie
Jak dlouho musí procházet roztokem síranu měďnatého $ ( CuSO_4 ) $ proud 1,5A, aby se z něj vyloučilo 30g mědi? $ A = 0,329 \cdot 10^6 kg \cdot C^{-1} $.